

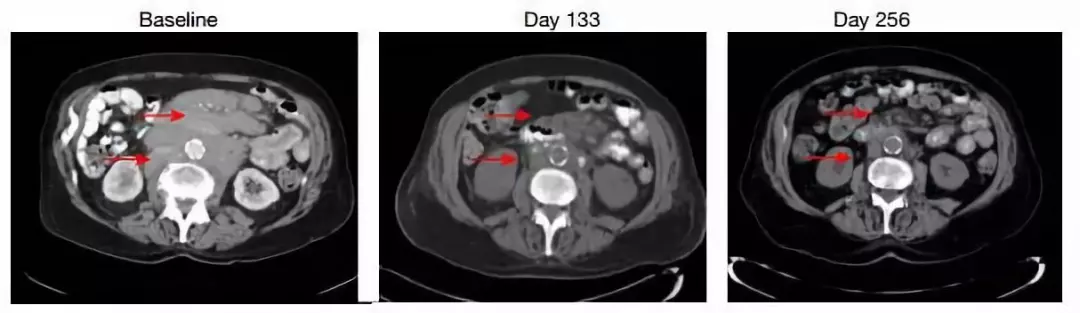
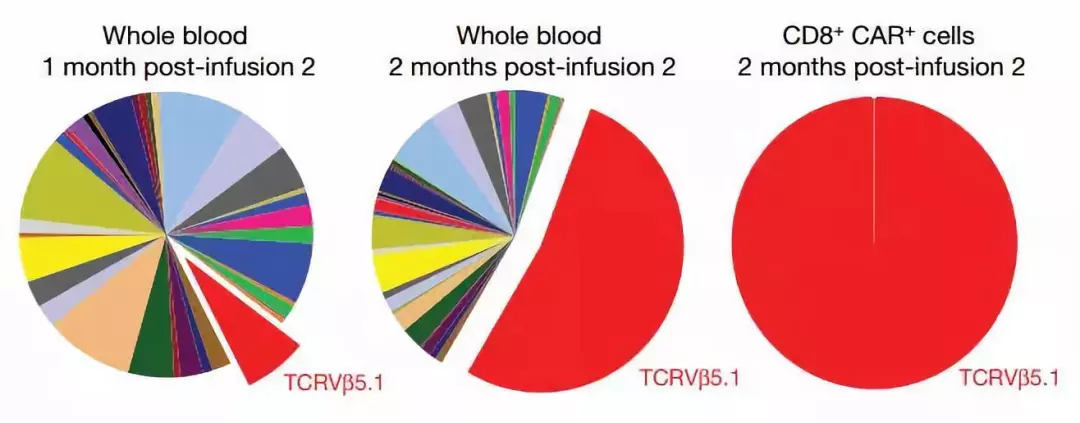
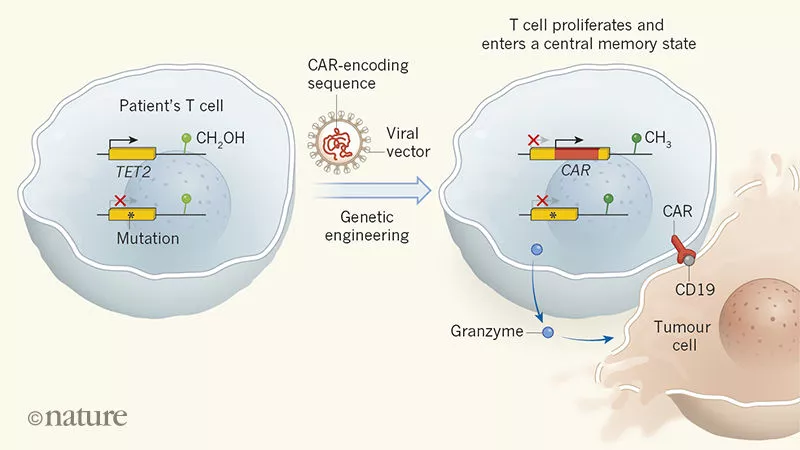
CAR-T疗法因其在白血病、淋巴瘤等癌症治疗中的光明前景而广受关注。这种刚刚进入市场的新型疗法,通常需要向患者体内注射上亿个经过基因工程改造的T细胞。然而,在今天发表在《自然》杂志上的一篇论文中,来自宾夕法尼亚大学的研究人员却指出,几乎是一个CAR-T细胞,就治愈了一位白血病患者。这一诞生于意外的发现,可能改变CAR-T疗法的思路。 2013年,一位罹患慢性淋巴细胞白血病(CLL)的78岁男性患者在宾夕法尼亚大学艾布拉森癌症中心接受一项CAR-T疗法的临床试验。这项由CAR-T疗法的先驱卡尔 · 朱恩(Carl June)教授和约瑟夫·梅伦霍斯特(Joseph Melenhorst)助理教授共同领导的研究,希望验证这种全新的癌症疗法在白血病治疗中的效果。 约瑟夫·梅伦霍斯特(右)与论文第一作者约瑟夫·弗拉耶塔(左)(来源:宾州州立大学) CAR-T疗法:癌症治疗新希望 CAR-T全名为嵌合抗原受体T细胞,是一类经过基因工程改造,能够特异性消灭肿瘤细胞的免疫细胞。 在人体中,作为消灭肿瘤细胞的主要力量,T细胞在正常情况下处于平静状态。为了激活T细胞,另一类免疫细胞——树突状细胞从肿瘤表面或内部提取某种蛋白并交给T细胞:“这就是你要攻击的抗原”。树突状细胞发出的信号激活了T细胞,它们开始迅速增殖、杀伤肿瘤细胞。 然而,众所周知的是,T细胞常常在与肿瘤细胞的较量中败下阵来,这是因为肿瘤细胞有独特的技巧来躲避攻击。肿瘤细胞由正常细胞癌变产生,因而它们与正常细胞有着诸多相似之处。为了避免误伤友军,免疫系统演化出了一套保护机制:在检测到特定抗原后,它们还要确认对方表面含有两类分子(绑定抗原的主要组织相容性复合体,即MHC;开火信号——共刺激配体),才会发起攻击。这种保护机制给了肿瘤细胞可乘之机:它们可以停止产生这两种分子,从而逃脱T细胞的查杀。 能不能对T细胞进行改造,让研究人员自己为T细胞选择目标抗原呢?例如,让T细胞检测到抗原就直接发动进攻,而不需要等待开火命令?通过基因工程改造T细胞的想法由此诞生。20世纪末,朱恩等人开始研究向T细胞导入一种基因,这种基因可编码一种名为嵌合抗原受体(CAR)的蛋白。CAR蛋白能与特定的抗原结合,让T细胞跳过多余的辨别步骤,直接攻击癌细胞。 抗原的标准显而易见:癌细胞上有,而正常细胞没有,从而避免误伤正常组织。目前,研究人员找到的是攻击目标是某些白血病和淋巴瘤细胞携带的CD19表面蛋白。近些年来,CAR-T疗法在临床试验中对这些非实体瘤展现出了很好的效果。去年8月,FDA批准了首款针对急性淋巴细胞白血病(ALL)的CAR-T疗法,针对某些淋巴瘤的CAR-T疗法也在今年5月刚刚问世。 51天:姗姗来迟的疗效 CAR-T疗法虽然疗效显著,但它伴随着严重的副作用。当过多的T细胞被同时激活,一种名为“细胞因子释放综合征”的副作用有可能是致命的。因此,研究人员在临床试验中的药物用量控制上需要格外谨慎。患者通常需要依次接受3组剂量递增的药物注射,以尽可能减轻副作用。 在宾夕法尼亚大学医院,故事中的这位患者正按照这一步骤接受治疗。注射了第一阶段低剂量的药物后,患者出现了典型的细胞因子释放综合症,由于剂量有限,其病情持续发展。70天后,第二阶段中等剂量的注射如期进行。 然而,一个月后,患者的状况并没有按照预想的方向发展。他的身上没有出现细胞因子释放综合征,其病情也没有得到好转,这意味着CAR-T细胞没有发挥作用。事实上,由于CAR-T可能在患者体内无法增殖,或者肿瘤细胞有可能产生突变,CAR-T疗法不能对所有患者起效。而几乎所有取得疗效的患者,都在一个月内出现癌细胞被抑制的现象。因此,人们当时认为,这位患者的治疗可能以失败告终。 在第二阶段治疗后的第51天,情况出现了变化。“直到治疗后的第51天,这位患者才出现了细胞因子释放综合症,这意味着CAR-T细胞开始活跃,抗癌效果或许开始出现。”梅伦霍斯特回顾了当时的情况。随后,CT影像结果也证实了梅伦霍斯特的猜测:患者体内的肿瘤开始变小。确认疗效后,患者继续接受了第三阶段,也就是最高剂量的注射。幸运的是,他的病情最终得到彻底的控制。5年后的今天,患者癌细胞消失,生存状况良好。 接受治疗后,患者肿瘤大小的变化(来源:研究论文) 意外:来自一个细胞的癌症杀手 这位高龄患者几经波折,最终得以痊愈。这则抗癌故事以完美的结局收尾,但参与了这项试验的科学家,却从这位特殊的CLL患者身上看到了新的疑问。为什么CAR-T疗法在他身上延迟了至少20天才发挥作用?“从每一位患者身上,我们都可以学到很多东西。我们从病床旁回到实验室中,希望尽可能理解在他身上发生了什么。”朱恩说。 为此,宾夕法尼亚大学的研究人员追溯了患者体内CAR-T细胞的来源。结果令人惊讶:94%的CAR-T细胞都由一个CAR-T细胞增殖而来。也就是说,他的白血病几乎是被一个细胞击败的。值得注意的是,在第二阶段治疗后一个月的那次检查中,研究人员并没有检测到它们。但随后,它在体内繁殖了29代,最终清除了全部的癌细胞。 接受治疗两个月后,患者体内几乎只剩下一种CAR-T细胞(红色)(来源:研究论文) 正如文章第一部分所介绍的那样,研究人员通过改造患者的T细胞,使其能够编码嵌合抗原受体(CAR)、识别CD19蛋白。在操作过程中,编码CAR的基因片段通过基因改造过的病毒,随机插入患者的DNA中。而在这个特殊案例中,研究人员发现,CAR序列被意外插入了一个名为TET2的基因中。TET2的主要功能是调控血细胞的生成,并监控其增殖速率。经过这番操作,这个CAR-T细胞的TET2结构被破坏,细胞开始迅速增殖并消灭白血病。而在肿瘤细胞被消灭后,这些CAR-T细胞含量回落,让位于正常的T细胞。这也解释了为什么患者经过51天才见效:相比于多个CAR-T细胞同时发挥作用,由一个CAR-T细胞增殖至足够多的数量,需要更长时间。 相比于正常CAR-T细胞,CAR插入TET2使其失效后,CAR-T细胞增殖速率更快。(来源:Nature News) 此前,人们对TET2的认识集中在它对血细胞数量的调控,以及它的突变可能导致克隆性造血、进而引发白血病。而在这项研究中,朱恩等人通过体外试验,发现TET2还与很多此前未知的功能有关。删除TET2除了能让T细胞迅速增殖,还帮助细胞维持在一种名为中央记忆的状态,这种状态下的T细胞能更准确地定位肿瘤细胞。TET2的删除还能减少T细胞释放的细胞因子,减轻那可能致命的副作用。 “这项发现着实令人震惊,它告诉我们,CAR-T疗法的最小剂量可能只需要一个细胞。”这篇论文的第一作者约瑟夫·弗拉耶塔(Joseph Fraietta)说。毫无疑问,这项研究对CAR-T疗法的研发起到革命性的推动作用。如果抑制TET2表达在增强CAR-T疗效中的作用最终得到证实,CAR-T疗法中的细胞用量将可能从目前的5000万~5亿减少至几个。这将带来等待治疗时间的缩减,以及成本的降低。不过,研究团队同时指出,由于TET2的突变可能导致白血病,因此在后续研究中需要重视潜在的风险。 原始论文: Disruption of TET2 promotes the therapeutic efficacy of CD19-targeted T cells 参考链接: CLL patient goes into remission thanks to single CAR T cell Tumour tamed by transfer of one T cell

 cruboy
cruboy